医疗器械临床前大动物实验
 2021年08月24日 |
2021年08月24日 | 阅读次数:378
阅读次数:378什么是临床前大动物实验?
大动物实验是在医疗器械注册进程中,人体试验之前开展的旨在控制风险的验证活动。
动物实验是评价医疗器械安全性和有效性研究中的重要手段之一,可为产品设计定型提供相应的证据支持;若需开展临床试验,可为医疗器械能否用于人体研究提供支持,降低临床试验受试者及使用者的风险以及为临床试验设计提供参考。
医疗器械临床前动物实验有什么相关法规?
Relevant Regulations
2019年4月18日,为加强医疗器械注册工作的监督和指导,进一步提高医疗器械注册审查质量,国家药品监督管理局组织制定了《医疗器械动物实验研究技术审查指导原则第.一部分:决策原则》。这是开展动物实验判定路径依据,具有里程碑的意义。这是国家药监部门首.次发布关于动物实验的官方文件,结束了医疗器械动物实验长期无规可循的局面。
2019年11月27日,为了进一步规范医疗器械动物实验研究,医疗器械技术审评中.心组织起草了《医疗器械动物实验研究技术审查指导原则 第.二部分:实验设计、实施质量保证(征求意见稿)》,该原则为医疗器械动物实验研究技术审查指导原则系列中的第.二部分,申请人可参照该指导原则开展动物实验设计、实施与质量保证相关工作,将进一步指导申请人在适当负担下更高质量地开展医疗器械动物实验研究。
开展动物实验的决策原则是什么?
Decision Making Principles
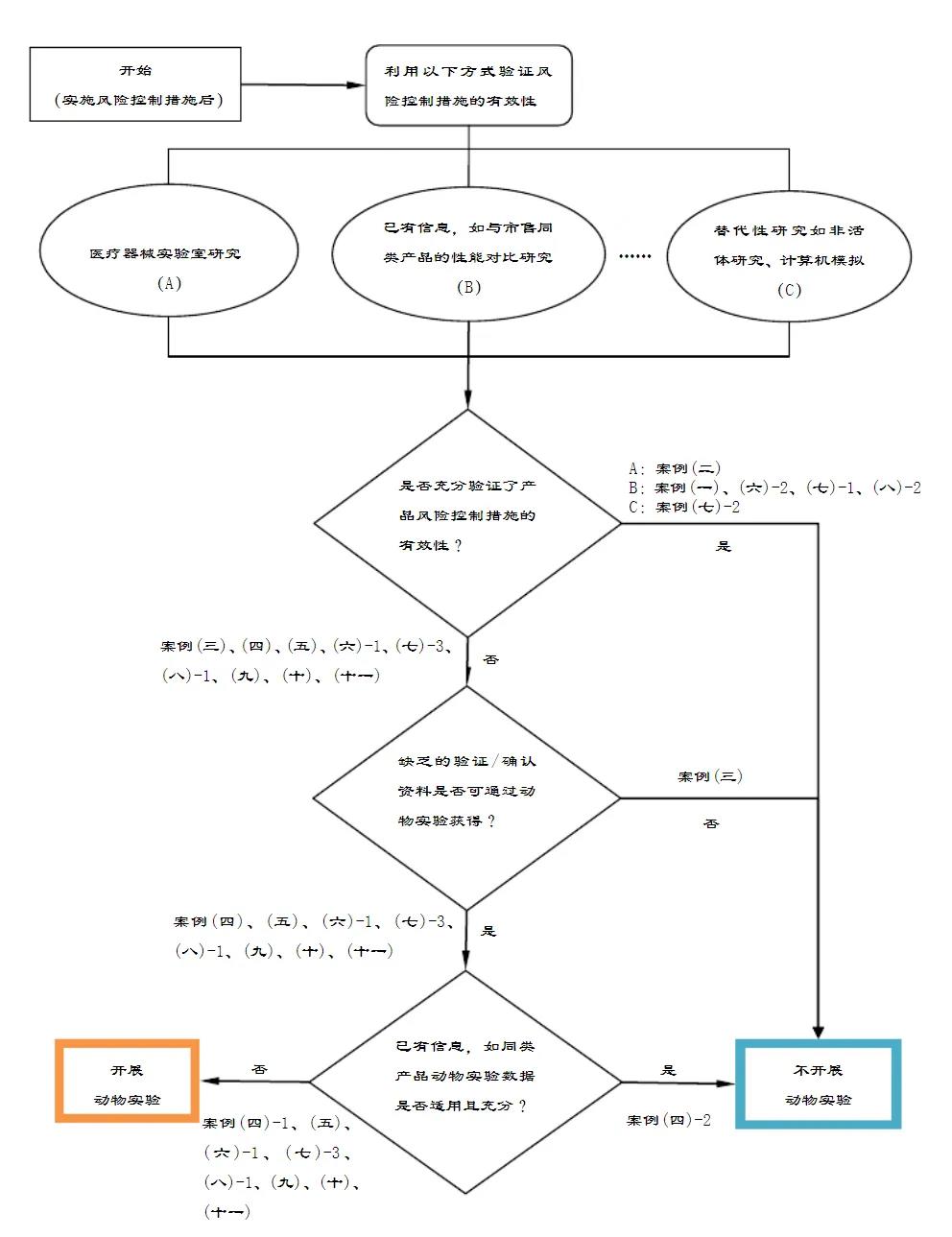
申请人可参考《医疗器械动物实验研究技术审查指导原则第.一部分:决策原则》中的决策流程图进行是否开展动物实验的决策。
动物福利伦理原则
申请人需遵循动物福利伦理原则:“替代(Replacement)、减少(Reduction)和优化(Refinement)” 原则,即3R原则。
申请人在决策是否开展动物实验前,需要特别考虑动物福利伦理,充分开展实验室研究,不宜采用动物实验替代实验室研究。
若有经过确认/验证的非活体研究、计算机模拟等方法,则优先采用上述方法以替代动物实验。
申请人宜充分利用已有的信息获取产品安全性、有效性和可行性的相关证据,如何利用已有的同类产品动物实验数据或通过与市售同类产品进行性能比对等方式验证产品的安全性、有效性和可行性。若相关证据充分,可免于动物实验。
风险管理原则
在医疗器械设计开发时应进行充分的风险管理活动。风险控制作为风险管理的重要部分,是将风险降低并维持在规定水平的过程。实施每一项风险控制措施后应对其有效性予以验证(其中包括确认活动)。实验室研究或动物实验等均是验证风险控制措施有效性的手段,申请人宜尽可能地通过前期研究(如实验室研究等)对已识别风险的控制措施有效性进行验证,只有在实验室研究不足时,才考虑通过动物实验开展进一步验证。动物实验资料可作为风险/受益分析时的支持性资料。
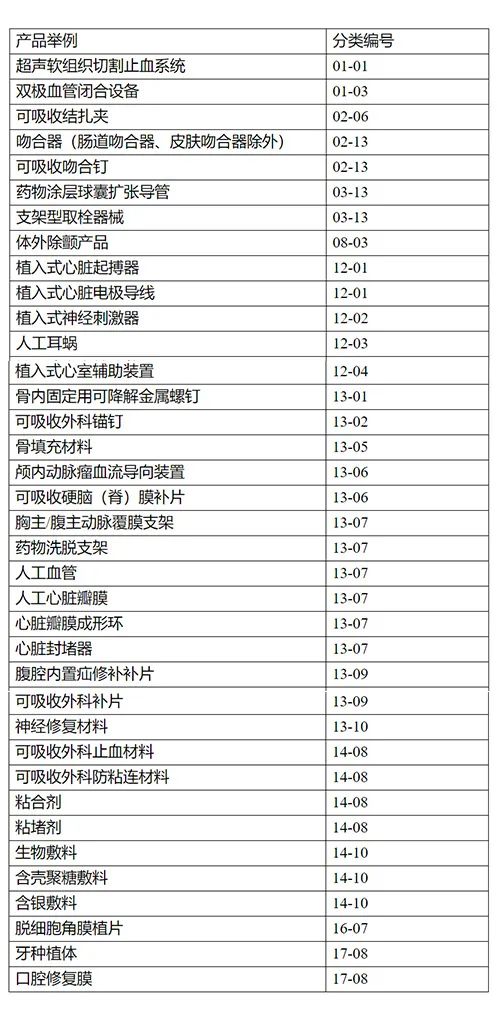
哪些医疗器械明确需要做大动物实验?
Medical Equipment
为何选择科标医学检测
About Us
江苏科标医学检测有限公司,是经过CMA、CNAS、GLP等质量体系认证认可的第三方检验检测服务机构,专注服务医疗器械企业、药企与科研院所等。
我们拥有国内先进的技术水平,和经验丰富的专.业技术团队,配备高质量体系要求以及按照国.际标准ISO17025和美国21 CFR Part 58标准建造的实验室,为企业提供专.业的检测服务,所出具的检测报告均符合医疗器械国内注册,CE注册,FDA注册法规要求。
我们可提供骨科、各类腔镜、植入类生物材料、补片、微创外科手术器械、牙科种植体等其他植入类医疗器械的性能及安全性检测,遵循快速高效的运营方式及严格的质量管理要求,助力企业产品快速合规上市。









