分类列表
0519-83587899contact@jcssmt.com
咨询热线:
0519-83587899
0519-83587899
医疗器械的使用寿命是指医疗器械从规划、设计、生产、销售、安装调试到使用、维修、维护检测、报废的全过程。而医院使用的医疗器械的应用质量和安全管理在整个寿命过程中占重要地位。
根据现行法规、产品上市情况,对医疗器械产品的寿命界定方法做以下简单总结:
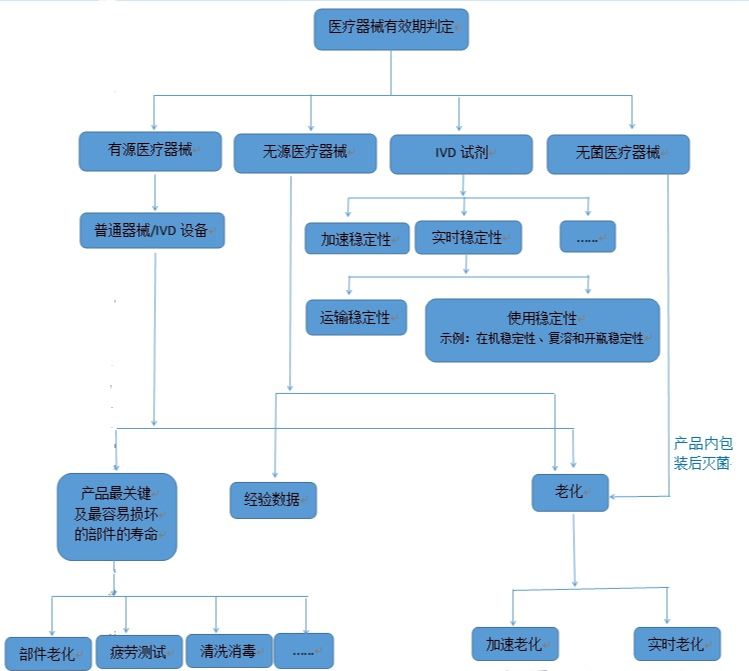
需要注意的是,加速老化包括部件老化和整机老化,有源医疗器械受使用环境、使用条件的影响较大,一般不采用整机实时老化,比如一台电脑,放置5年不使用跟一直使用5年的结果肯定不一样,对于结构相对简单的、寿命较短的器械比较适用。无菌产品的老化必须在产品内包装后灭菌再进行,且实时稳定性试验和加速稳定性试验应同时进行,实时稳定性试验结果是验证产品货架有效期的直接证据。当加速稳定性试验结果与其不一致时,应以实时稳定性试验结果为准。
---------------------------------货架有效期验证内容-------------------------------------
1. 验证试验类型
医疗器械货架有效期的验证试验类型通常可分为加速稳定性试验和实时稳定性试验两类。
(1)加速稳定性试验
(2)实时稳定性试验
实时稳定性试验是指将某一产品在预定的储存条件下放置,直至监测到其性能指标不能符合规定要求为止。
无源植入性医疗器械的实时稳定性试验和加速稳定性试验应同时进行。实时稳定性试验结果是验证产品货架有效期的直接证据。当加速稳定性试验结果与其不一致时,应以实时稳定性试验结果为准。
2. 验证试验检测/评价项目
无论加速稳定性试验还是实时稳定性试验,注册申请人均需在试验方案中设定检测项目、检测方法及判定标准。检测项目包括产品自身性能检测和包装系统性能检测两方面。前者需选择与医疗器械货架有效期密切相关的物理、化学检测项目,涉及产品生物相容性可能发生改变的医疗器械,需进行生物学评价。如适用,可采用包装封口完整性检测用于替代无菌检测。后者则包括包装完整性、包装强度和微生物屏障性能等检测项目。其中,包装完整性检测项目包括染色液穿透法测定透气包装的密封泄漏试验、目力检测和气泡法测定软性包装泄漏试验等;包装强度测试项目包括软性屏障材料密封强度试验、无约束包装抗内压破坏试验和模拟运输试验等。
建议注册申请人在试验过程中设立多个检测时间点(一般不少于3个)对无源植入性医疗器械进行检测。可采用零点时间性能数据作为检测项目的参照指标。
3. 进行验证试验的产品
医疗器械货架有效期验证试验应采用与常规生产相同的终产品进行。验证的医疗器械建议至少包括三个代表性批次的产品,推荐采用连续三批。注册申请人可对试验产品进行设计最差条件下的验证试验以保证试验产品可代表最恶劣的生产情况,如进行一个标准的灭菌周期后,附加一个或多个灭菌周期,或采用几种不同的灭菌方法。
4. 参考引用的标准
ASTM F 1980-2002 无菌医疗设备包装加速老化标准指南;
YY/T 0681.1-2009 无菌医疗器械包装试验方法 第1部分 加速老化实验指南
YY/T 1579-2018 体外诊断医疗器械体外诊断试剂稳定性评价
2017年第75号 无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)
2018年09月29日 《有源医疗器械使用期限技术审查指导原则(征求意见稿)》