医疗器械毒理学 ISO 10993-17:2002 ISO 10993-18:2020
 2020年08月11日 |
2020年08月11日 | 阅读次数:351
阅读次数:351毒理学风险评估是医疗器械生物学评价的组成部分之一,通过比较人体在使用器械的过程中直接或间接暴露于可沥滤(可析出)的物质的量与其相应的允许限量,以评估物质的安全性风险。毒理学风险评估通常可评价包括全身毒性(急性毒性、亚急/亚慢性毒性和慢性毒性等)、遗传毒性、生殖/发育毒性和致癌性在内的生物学终点。尤其是新版ISO 10993-1:2018实施后,监管机构对长期接触人体的器械(尤其植入类)的长期全身毒性和致癌性评价终点尤为关注。由于这些生物相容性测试中动物使用数量多、试验周期长等,通常可采用毒理学风险评估对上述生物学终点进行评价,从而豁免不必要的动物试验,优化生物学评价方案,最终达到产品安全性评价的目的。FDA发布的《Use of International Standard ISO 10993-1,"Biological evaluation of medical devices - Part 1: Evaluation and testingwithin a risk management process"》(2016)、ISO指导原则 10993-1:2018及国标GB/T16886.1:2011-中均明确了这一评价思路。
医疗器械的毒理学风险评估主要遵循ISO 10993-17:2002。现行ISO 10993-17:2002版本中描述了医疗器械可沥滤物的人体允许限量的确定方法,其最心修订草案中从整体框架上对产品中化学成分的毒理学风险评估进行了阐述,主要包括四个部分:危害识别、剂量-反应评估、暴露量评估、以及风险判定。即:识别器械中可能存在危害的物质,通过比较这些物质在人体中的无不良反应剂量与相应的人体暴露量,最终判定其安全性风险是否可接受。
1
危害识别
通常开展器械的化学表征测试(ISO 10993-18:2020)以识别可能暴露于人体的物质。如果测试结果表明,拟评估产品与前期产品具有等同性(如产品发生微小变更等),不存在额外的安全性风险,则可借助已有产品的临床安全性应用数据评估现有产品的安全性风险。当前期安全性数据不足时,需检索其它已有的研究资料,必要时采用Read-across或In Silico方法,以获取足够的毒性信息评估化学表征分析测试所识别的物质安全性。一般认为研究资料的权重由大到小排序为:人群流行病学研究>人体毒理学研究>哺乳动物体内试验>体外试验>In Silico。
2
剂量-反应评估
剂量-反应评估用于确定物质的毒性反应与暴露剂量之间的关系。对于器械中存在安全性风险的物质,应根据上述毒性信息,选择数据质量较高的、保守的、临床相关的、敏感的毒性数据(如NOAEL、LOAEL、BMD、TTC等)作为POD(Point of Departure),并应用修正因子(MF= UF1 * UF2 *UFn )(见表1)推导该物质的可耐受摄入量(TI),即TI = POD/MF 。通常认为在一定期限内连续每日暴露于TI水平时,该物质不会对人体带来健康危害。

表1. 用于TI推导的不确定因子
TI推导时还应考虑:
根据预期临床应用,选择最相关的毒性数据,如选择慢性毒性数据评估长期使用期限的器械、目标人群中包含孕妇时需评估生殖/发育毒性终点;
对于结构类似或具有共同作用机制的一类物质,需注意其叠加效应评估;
对于致突变性致癌物,需采用较为保守的TTC或根据已有的致癌性数据基于风险发生概率外推其致癌性TI值;
应用In Silico辅助预测毒性信息时,需考虑物质的适用范围,基于化学结构预先排除一些金属、蛋白质、高分子聚合物、高致癌性物质等,并根据分析结果选用相应暴露期限的TTC(见表2和表3),可参见ICH M7(R1):2017和ISO/TS 21726:2019;
当MF>100,000时,需考虑用于评估的毒性数据的适用性。
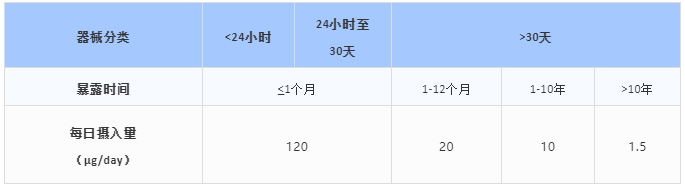 表2. 含有警示结构化学物的TTC
表2. 含有警示结构化学物的TTC
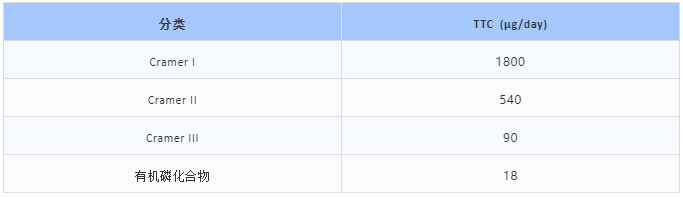
表3. 有机磷及基于Cramer分类物质的TTC
3
暴露量评估
如果已有的人体临床暴露数据能代表最严苛的临床应用情形,则使用这些数据进行评估。然而,这类数据往往较难获取或不能代表最严苛的临床应用,通常开展基于ISO 10993-18:2020的化学表征测试以评估人体每日最打暴露量(HDE)。暴露评估时需考虑敏感人群、最打使用数量、最长暴露期限等因素,同时采用严苛的暴露假设,如认为化学表征测试的每种浸提物质均可每日100%暴露于人体。
4
风险判定
TI与HDE的比值即为MOS(Margin of Safety),其数学计算公式MOS=TI/HDE。MOS是进行风险判定的辅助工具。当MOS远大于1时,通常认为物质的安全性风险可接受;MOS远小于1,推荐基于ISO 14971:2019采用风险策略控制(如标签说明);当MOS接近于1时,需结合暴露评估、毒性类型及严重程度、器械临床应用等综合评估,必要时需考虑优化暴露量评估、追加生物学测试,或者风险控制等评价策略。
以一项某一次性使用器械产品为例。该产品单次使用时间不超过30分钟,结合终生累积使用频率的可能性,认为该产品属于短期接触(<24小时)的外部接入器械。其适用人群不仅包括成人、还包括较为敏感的孕妇和儿童群体,因此,需考虑系统毒性和生殖/发育毒性的评价终点。结合预期临床应用,采用加严浸提的方法开展化学表征测试,以获取较严苛的人体每日最打暴露量。对提取液中高于报告限的所有物质逐一进行毒性信息评估,除一种金属元素—镍的MOS值在儿童群体中略大于1外,其它所有物质在目标人群中的MOS均远大于1。考虑到该产品单次和累积使用期限短,暴露评估时采用了较严苛的浸提条件及暴露假设,且选用了远严苛于实际临床暴露期限的终生暴露安全限值作为TI,故认为其安全性风险可接受。








